我们:肯定可以,这是最重要的!
您:我不听,我不听,我要买MNM来吃,补充NAD+浓度。
我们:朋友,MNM只在动物上做过实验,未经过临床验证,要慎重吃哦!!
您:我不听,我不听。
我们:运动、健康饮食才是第一位,看看人家大佬们80多岁年龄,40多岁身体,我们呢?
您:行,要不试试准时睡觉、适量运动、健康饮食......
NAD+的有效性随着年龄和某些疾病状况而降低。烟酰胺单核苷酸(NMN)是一种关键的NAD+中间体,已被证明可以增强NAD+生物合成并改善小鼠疾病模型中的各种病理。在这项研究中,我们在正常衰老期间对常规食物喂养的野生型C57BL/6N小鼠进行了为期12个月的NMN给药。口服NMN可快速用于组织中合成NAD+。值得注意的是,NMN有效缓解了小鼠年龄相关的生理下降。在没有任何明显的毒性或有害影响的情况下,NMN抑制了与年龄相关的体重增加,增强了能量代谢,促进了体力活动,改善了胰岛素敏感性和血脂水平,改善了眼功能和其他病理生理学。与这些表型一致,NMN防止了关键代谢器官中与年龄相关的基因表达变化,并增强了骨骼肌中线粒体氧化代谢和线粒体核蛋白失衡。NMN的这些作用突出了NAD+中间体作为人类有效抗衰老干预措施的预防和治疗潜力。

引言
历史上前所未有的全球人口老龄化趋势预计将成为政府医疗财政的持续负担。为了使衰老过程健康并防止昂贵的与年龄相关的健康问题,最近加强了开发有效、负担得起的抗衰老干预措施的努力,产生了一些有前途的化合物,如二甲双胍、雷帕霉素和SIRT1激活剂。尽管这些化合物最初是作为药物开发的,但一些内源性化合物即使在很老的时候也有可能实现健康和富有成效的生活。
哺乳动物中的关键NAD+中间体烟酰胺单核苷酸(NMN)和烟酰胺核糖(NR)可能是此类候选物。NMN由维生素B3的酰胺形式烟酰胺(Nic)和5'-磷酸核糖基焦磷酸(PRPP)通过烟酰胺磷酸核糖基转移酶(NAMPT)合成。NR被烟酰胺核糖激酶(NRK)磷酸化为NMN。一旦合成NMN,它就会被三种NMN腺苷酸转移酶NMNAT1-3转化为NAD+。据报道,短期服用NMN或NR对代谢并发症和其他疾病有显著的治疗效果。例如,我们已经表明,NMN改善了老年野生型小鼠和一些遗传小鼠模型中葡萄糖刺激的胰岛素分泌的损伤。NMN治疗还显著改善饮食和年龄诱导的2型糖尿病或肥胖小鼠模型中的胰岛素作用和分泌。此外,NMN通过防止缺血诱导的NAD+减少,保护心脏免受缺血/再灌注损伤,维持神经干/祖细胞群,恢复老年小鼠骨骼肌线粒体功能和动脉功能、改善线粒体功能、阿尔茨海默病啮齿动物模型中的神经死亡和认知功能。NR还能够改善肥胖小鼠模型和各种线粒体疾病模型中的线粒体功能障碍,减轻阿尔茨海默病模型小鼠的认知退化,防止DNA损伤和肝细胞癌形成,改善噪声引起的听力损失,并保持肌肉干细胞功能。总之,这些发现强烈表明,通过施用NMN或NR增强NAD+生物合成是针对多种疾病的有效治疗干预措施。
有趣的是,已经证明,增强NAD+生物合成可以延长酵母、蠕虫和苍蝇的寿命。在啮齿类动物和人类中,许多研究表明,NAD+含量随着年龄的增长而下降,包括胰腺、脂肪组织、骨骼肌、肝脏、皮肤和大脑等多个器官。因此,使用NMN或NR增强NAD+生物合成有望对衰老自然过程中的各种病理生理变化提供显著的预防作用。为了解决这个关键问题,需要在正常条件下对野生型小鼠进行长期给药研究。
为了检查长期服用NMN是否对年龄相关的病理生理变化显示出预防作用,我们在饮用水中用两种不同剂量的NMN处理了常规食物喂养的野生型小鼠12个月。我们评估了多种功能特性,以及长期安全性和毒性,发现NMN能够显著改善小鼠与年龄相关的生理衰退。我们从这项长期给药研究中的发现为将NMN开发为一种人类有效的抗衰老化合物提供了概念证明。
结果
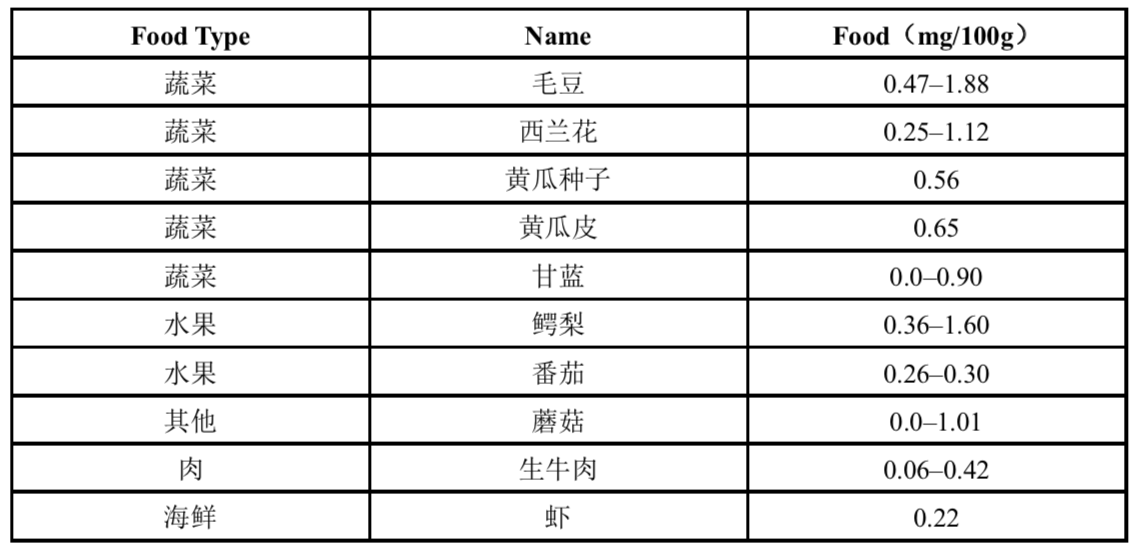
多种天然食品中含有NMN
最后,我们发现NMN确实包含在一些日常天然食物来源中(表1)。例如,毛豆(未成熟大豆)、花椰菜、黄瓜和卷心菜等蔬菜每100克含有0.25–1.88毫克NMN。鳄梨和番茄等水果也含有0.26–1.60 mg/100g。生牛肉和虾的NMN含量相对较低(0.06-0.42 mg/100g)。考虑到人类红细胞总含有约50 mg NMN(我们未发表的观察结果),生理上相关量的NMN可能会从各种日常食物来源吸收到我们的身体,并有助于维持NAD+生物合成和整个身体的许多生理功能。
口服NMN可增加血浆NMN和组织NAD+水平
在我们之前的研究中,我们发现,在常规食物喂养的野生型小鼠中,一次性腹腔注射NMN(500 mg/kg体重)会在15分钟内增加肝脏、胰腺和白色脂肪组织(WAT)中的组织NMN和NAD+水平。为了使长期服用NMN成为可能,我们决定测试低剂量的NMN,并将其添加到饮用水中。我们确认,93–99%的NMN在室温下的饮用水中保持完整7–10天(图S1A)。接下来,我们通过口服管饲法向小鼠施用300 mg/kg体重的NMN,并在30分钟内测量血浆NMN和肝脏NAD+水平。血浆NMN水平在2.5分钟时急剧增加,从5分钟进一步增加到10分钟,然后在15分钟时恢复到原始水平(图1A),表明肠道吸收非常快。与这一概念一致,肝脏NAD+水平在15至30分钟内稳定增加(图1A)。我们还测量了NMN口服灌胃后60分钟的组织NAD+水平。尽管在该特定剂量下差异没有达到统计学意义,但在肝脏、骨骼肌和大脑皮层中观察到NAD+水平相对较小的增加,但在WAT或棕色脂肪组织(BAT)中没有观察到(图1B和S1B)。为了进一步确认口服NMN是否用于合成组织中的NAD+,我们使用了双标记同位素NMN(C13-D-NMN;图S1C),并通过质谱法追踪了肝脏和比目鱼肌中NAD+的这些标记。有趣的是,在肝脏中,通过口服灌胃给药C13-D-NMN后,我们在10分钟时清楚地检测到双标记NAD+(C13-D-NAD+),并且在30分钟时C13-D-NAD+的水平进一步增加(图1C和S1D)。在比目鱼肌中,我们在30分钟时检测到C13-D-NAD+,但在10分钟时未检测到(图1C和S1D)。这些结果表明,口服NMN可被快速吸收,有效地输送到血液循环中,并在主要代谢组织中立即转化为NAD+。
为了确定长期服用NMN对年龄相关病理生理的影响,我们使用常规食物喂养的野生型C57BL/6N小鼠进行了为期12个月的NMN服用研究(图1D和S1E)。我们测试了两种剂量的NMN,100和300mg/kg/天,从5个月到17个月大。在此期间,我们通过测量对照组和NMN给药小鼠的水摄入量,仔细监测了小鼠对NMN的耐受性,发现在12个月内,NMN的给药耐受性良好(见下文)。当小鼠喝一小口含NMN的水时,这种长期口服给药方案可能会导致血浆或组织NMN和NAD+的稳态水平非常小的增加。然而,在技术上很难检测血浆或组织NMN和NAD+水平的如此小的波动。尽管如此,我们观察到肝脏和BAT中NAD+随时间呈剂量依赖性增加的趋势,但在其他组织中,包括骨骼肌和WAT中没有这种趋势(图1E)。
NMN给药小鼠显著抑制与年龄相关的体重增加
接下来,我们评估了对照组和NMN给药小鼠的各种生理、生化和分子参数。我们发现,NMN给药显著且剂量依赖性地抑制了与年龄相关的体重增加(图2A和2B)。时间和组之间存在统计学上高度显著的相互作用(P<0.001 from the two-way repeated measures anova)。此外,线性剂量依赖性效应在4–12个月的所有时间点都具有统计学意义(pg/天组中,正常对照小鼠的平均体重减少百分比分别为4%和9%。通过绘制各组体重增加图,NMN对年龄相关体重增加的抑制作用变得更加明显(图2B)。同样,时间和组间的相互作用具有统计学上的高度显著性(P<0.001 from the two-way repeated measures anova),线性剂量依赖性效应在2–12个月的所有时间点都具有显著性(pg/天组的脂肪质量减少,瘦肉质量增加(图S1F)。NMN给药小鼠和对照小鼠在体长方面没有显示出任何可识别的差异(图S2A)。有趣的是,当小鼠变老时,与对照小鼠相比,NMN给药小鼠能够以剂量依赖的方式维持更高水平的食物和水消耗(图2C和2D)。这些结果证实,NMN对体重的影响并非由于生长缺陷或食欲下降。此外,对血细胞计数(图S2B–E)、血液化学小组(图S2F–W)和尿液(图S2X)的分析均未检测到NMN在任何剂量下的任何明显毒性迹象。在对照组、100和300mg/kg/天NMN给药的小鼠队列之间,通过对数秩检验,在整个干预期内小鼠的存活率没有检测到统计学差异。对照组和NMN给药小鼠的死亡原因(包括尿路梗阻、血栓形成和心肌梗死)没有明显差异(图S3A)。这些结果表明,在常规食物喂养的小鼠中,NMN给药可以以剂量依赖的方式显著抑制与年龄相关的体重增加,而在整个12个月的干预期间没有显示任何严重的副作用。
NMN给药的小鼠在暗照期间表现出增强的能量代谢和更高的体力活动
由于与对照小鼠相比,NMN给药小鼠在衰老过程中表现出更高的食物摄入量,但体重较低,因此我们测量了对照、100和300 mg/kg/天NMN给小鼠在6个月和12个月时间点的耗氧量、能量消耗和呼吸商(图3A–E)。100和300 mg/kg/天组在光照和暗照期间耗氧量显著增加(图3A)。100 mg/kg/天组24小时内和300 mg/kg/天的光照期内,能量消耗也显著增加(图3B)。在光照和暗照期间,两组的呼吸商均显著降低(图3C),这表明NMN给药小鼠将其主要能量来源从葡萄糖转换为脂肪酸。尽管NMN给药小鼠偶尔表现出较高体温的趋势,但体温没有显著变化(图S3B)。有趣的是,尽管氧消耗和能量消耗显著减少,特别是在黑暗期,对照小鼠从6个月到12个月,但用NMN处理12个月的小鼠能够在NMN给药后6个月维持与对照小鼠接近的氧消耗和能源消耗(图3D和3E)。总之,这些结果有力地表明,NMN对常规食物喂养的野生型小鼠中与年龄相关的能量代谢损伤具有显著的预防作用。
我们还评估了12-15个月大的对照和NMN给药小鼠的一般运动活动。测量了活动(whole-body movements)和养育(vertical activity)(图3F和3G)。与对照小鼠相比,给予100 mg/kg/天NMN的小鼠在黑暗期表现出明显更高的每小时行走量,而给予300 mg/kg/天的NMN的老鼠表现出略低的行走量(图3F)。在饲养活动方面,对照组和100mg/kg/天组之间没有显著差异(图3G)。然而,300mg/kg/天组在整个黑暗期的饲养活动都有所下降(图3G)。因此,尽管NMN给药可以刺激老年小鼠的能量代谢和一般运动活动,但较低的剂量似乎是这些特定参数的最佳选择。
NMN给药小鼠表现出改善的胰岛素敏感性和血浆脂质分布
我们通过进行腹膜内葡萄糖和胰岛素耐受试验(分别为IPGTT和ITT)以及在治疗3、6、9和12个月时测量血浆脂质组,评估了NMN对葡萄糖和脂质代谢的影响。为了消除对照组和NMN给药小鼠之间体重差异可能引起的混淆效应(图2A),我们评估了对照组和服用NMN的小鼠体重匹配组中的这些代谢参数。在所有时间点,我们没有观察到对照组和100和300 mg/kg/天NMN给药组之间的葡萄糖耐量有任何显著差异(图S4A)。三组IPGTT期间血浆胰岛素水平无差异(图S4B)。三组空腹胰岛素水平均随时间增加。然而,300 mg/kg/天NMN给药组在治疗3至9个月后,空腹胰岛素水平趋于降低(图S4C)。有趣的是,与对照组相比,NMN给药组的喂食胰岛素水平显示出更低的胰岛素水平趋势(图S4D),而三组的喂食血糖水平没有差异(图S4E)。与这些胰岛素结果一致,在给予NMN 12个月后(小鼠17个月大),与体重匹配的对照组相比,给予NMN的小鼠显示出显著改善的胰岛素敏感性(图4A)。时间和组之间存在统计学上显著的相互作用(P=0.023 from the Greenhouse-Geisser test in two-way repeated measures ANOVA),在30分钟和45分钟时间点,线性剂量依赖性效应分别具有统计学意义或接近显著性(P=0.026 and P=0.061 in the one-way repeated measures ANOVA with unweighted linear term)。当绘制相对于0分钟时间点葡萄糖水平的葡萄糖变化百分比时(图4B),100和300 mg/kg组中胰岛素敏感性的改善变得更加明显,尽管在该评估中时间和组之间的相互作用没有达到统计学意义(P=0.091 from the Greenhouse-Geisser test in two-way repeated measures ANOVA)。即使包括所有小鼠,仍观察到胰岛素敏感性的类似改善(图S4F)。与这种改善的胰岛素敏感性一致,在NMN给药后6个月,两个NMN给药剂组的肝内甘油三酯水平(胰岛素抵抗的替代物)较低,而在NMN给予后12个月,300mg/kg/天组的肝内甘油三酯水平较低(图4C)。这些结果表明,长期服用NMN可以改善与年龄相关的胰岛素敏感性下降,而不受其对体重的影响。
我们还比较了三组中胆固醇、甘油三酯和游离脂肪酸(FFA)的血浆浓度。随着时间的推移,胆固醇和甘油三酯的血浆浓度显示出类似的变化。对于血浆FFA水平,时间和组之间的相互作用具有统计学意义(P=0.007 from the two-way repeated measures ANOVA),300mg/kg/天组没有显示出随时间的任何统计学意义的增加,而对照组和100mg/kg/天组显示随着时间的推移显著增加(在单向重复测量ANOVA中对受试者内效应的测试中Pg和300 mg/kg组的血浆FFA水平往往低于对照组,尽管每个时间点的差异没有达到统计学意义(图4D)。与体重匹配的对照小鼠相比,NMN给药小鼠的这一趋势似乎与较低的呼吸商(图3C)、较低的肝内甘油三酯水平(图4C)和较高的胰岛素敏感性(图4A)一致。
长期服用NMN可逆转外周组织中与年龄相关的基因表达变化,增强骨骼肌的线粒体呼吸能力
对NMN给药小鼠代谢参数的评估显示,NMN对减轻年龄相关的生理下降有显著作用。为了进一步评估NMN对分子事件的抗衰老作用,我们进行了微阵列分析,并在每组对照组和300mg/kg/天NMN给药小鼠的6个月和12个月时间点之间,比较了包括骨骼肌、WAT和肝脏在内的关键代谢器官的全局基因表达谱。在NMN治疗6至12个月(11至17个月大)期间,对照组的骨骼肌、WAT和肝脏中分别有300、360和513个基因发生了显著变化。大多数这些基因在这些时间点之间被下调(图5A)。值得注意的是,对照组小鼠骨骼肌、WAT和肝脏中分别有76.3%、73.1%和41.7%的基因发生了变化,在NMN给药小鼠中没有发生显著变化(图5A),这表明NMN能够防止这三种外周组织中与年龄相关的转录变化。尽管如此,在这三种关键代谢组织中,基于两次比较之间Z比率的绝对值之和(Z差异),在前20个基因中没有观察到共同基因(图S5A),这意味着NMN对转录的影响是组织特异性的。我们还对基因集富集(PAGE)进行了参数分析,发现分别显示对照小鼠骨骼肌、WAT和肝脏显著变化的55.5%、54.4%和32.2%的生物途径在NMN给药小鼠中没有显著变化(图5B)。NMN影响了这些组织中的多种生物途径,没有观察到明显的共同途径(图S4B)。然而,应注意的是,与免疫功能和炎症相关的几种WAT生物途径在老年对照小鼠中显著上调,而这些年龄诱导的改变在NMN给药小鼠中减弱(例如,细胞因子激活、白细胞激活、免疫应答;图S5B),表明NMN给药改善了与年龄相关的脂肪组织炎症增加,这是肥胖和胰岛素抵抗的标志(Berg and Scherer, 2005)。
接下来,我们对整个基因集进行了主成分分析(PCA),以进一步检查NMN给药对年龄相关转录变化的全局影响(图5C)。第一主成分(PC1)解释了数据集中20-23%的差异,并似乎将年轻小鼠(蓝色和绿色)的骨骼肌、WAT和肝脏的表达谱与年老小鼠(红色和橙色)的表达谱分开。有趣的是,与老年对照小鼠(红色)相比,NMN给药小鼠(橙色)表现出沿着PC1轴向年轻小鼠(蓝色和绿色)的转变,特别是在骨骼肌中,这支持了我们的观点,即NMN给药剂可防止与年龄相关的转录变化。
鉴于骨骼肌表现出NMN最深刻的预防作用,我们对对照组和300mg/kg/天NMN处理小鼠的渗透性骨骼肌进行了高分辨率呼吸测定。NMN处理小鼠的骨骼肌显示,添加线粒体解偶联剂FCCP诱导的最大呼吸速率显著增强,丙酮酸、ADP和琥珀酸刺激的线粒体氧化代谢增加趋势(图5D),表明NMN刺激骨骼肌中的线粒体氧化代谢。有趣的是,NMN给药还增加了骨骼肌线粒体提取物中线粒体DNA编码的线粒体蛋白MTCO1(细胞色素c氧化酶亚基1)和核DNA编码的心肌蛋白ATP5A(ATP合成酶亚基5α)或SDHB(琥珀酸脱氢酶复合物亚基B)的比率(图5E),这表明NMN在骨骼肌中诱导两种严重相关的线粒体改变,即线粒体核蛋白失衡和线粒体氧化代谢(Gomes et al., 2013; Houtkooper et al., 2013; Mouchiroud et al., 2013; van de Weijer et al., 2015)。总之,这些发现表明,NMN介导其抗衰老作用,至少部分通过以组织特异性的方式防止与年龄相关的基因表达变化,并增强骨骼肌中线粒体核蛋白失衡和线粒体氧化代谢。
长期服用NMN显著改善老年小鼠的眼功能、泪液分泌和骨密度
除了代谢功能外,我们还评估了对照组和NMN给药小鼠的其他病理生理变化。据报道,C57BL/6N小鼠株携带rd8突变,即Crb1基因中的单核苷酸缺失(Mattapallil et al., 2012)。这种特定突变导致视网膜下小胶质细胞和巨噬细胞的年龄依赖性积累,这与眼底浅色斑点的形成相对应(Aredo et al., 2015)。因此,我们对对照组和NMN给药小鼠进行了眼底生物显微镜检查。有趣的是,尽管所有5只17个月大的对照C57BL/6N小鼠的眼底都显示出许多浅色斑点,但分别在100和300 mg/kg/天剂量下,5只小鼠中有2只和4只显示出这些斑点的显著减少,这表明C57BL/6GN小鼠中由rd8突变引起的年龄相关的病理变化可能受到NMN的抑制(图6A)。为了评估长期服用NMN对视网膜反应的影响,我们进行了视网膜电图(ERG)。在ERG分析中,刺激和组之间存在显著的相互作用(P=0.009 from the two-way repeated measures ANOVA),两种剂量的NMN给药小鼠在0和5 db时表现出明显更高的振幅(P=0.035 and 0.022 for the 300 mg/kg group at 0 and 5 db, respectively; P=0.009 for the 100 mg/kg group at 5 db from the Dunnett T3 test in the one-way repeated measures ANOVA within groups),表明NMN能够防止C57BL/6N小鼠的杆细胞功能下降(图6B)。此外,在100和300mg/kg/天组的整个刺激范围内,观察到暗b波和光b波的改善,分别代表Müller/双极细胞功能和锥体细胞功能(图6C和6D),尽管刺激和组之间没有实现统计上显著的相互作用。由于人类和啮齿类动物的泪腺功能随着年龄的增长而降低(Zoukhri, 2006),我们还通过改良的Schirmer试验评估了对照组和NMN给药小鼠的泪腺产生。值得注意的是,在给予NMN 12个月后,NMN以剂量依赖的方式增加了泪液产量(图6E)。在300mg/kg/天组中观察到的泪液产量与小鼠一生中的最大泪液产量相当。除了NMN对眼功能的这些影响外,我们还检测到NMN给药小鼠的骨密度以剂量依赖的方式轻微但显著增加(图6F)。两种剂量的NMN给药也显著减少了中性粒细胞的数量,而300mg/kg/天的剂量则增加了淋巴细胞的数量(图S2D–E)。这些额外的发现支持了我们的观点,即NMN对多种年龄相关的病理生理变化具有显著的抗衰老作用。
英文原文
Gomes AP, Price NL, Ling AJ, et al. Declining NAD(+) induces a pseudohypoxic state disrupting nuclear-mitochondrial communication during aging. Cell. 2013.
NEWS CENTER
